一、实验原理
稳转株即稳定表达细胞株,指的是基于某一细胞系构建的持续过表达或干扰某特定基因的细胞系。慢病毒感染-药物筛选法是目前广泛应用的稳转株构建方法,具有高效整合、目标细胞广泛等特点。
将外源DNA克隆到具有某种抗性的载体上,载体被转染到宿主细胞并整合到宿主染色体中,用载体中所含的抗性标志进行筛选。最常用的真核表达载体的抗性筛选标志物有新霉素(neomycin)、潮霉素(hygromycin)和嘌呤霉素(puromycin),筛选得到可稳定表达目的蛋白,或者稳定表达沉默特定基因的细胞株。
二、应用简介
稳转株主要应用于以下研究中:
1、需要长期在目的细胞中研究基因功能。通过构建稳定株,可以大大降低频繁转染或者病毒包装的成本,也方便长期的实验研究;
2、部分蛋白半衰期及长,瞬时RNA只能干扰表达,无法去除已经表达的目的蛋白,通过构建稳定株可以实验更好的基因干扰效果;
3、瞬转会引入不可预期的拷贝数表达(往往瞬时表达较高),导致因为人为因素造成实验结果的不精确,构建稳定株可以帮助筛选到拷贝数适量的细胞进行实验研究;
4、稳转株可以用于诱导表达系统的实验,用于控制基因的时空表达;
5、需要用目的细胞构建动物模型的实验,往往需要构建成稳定株。
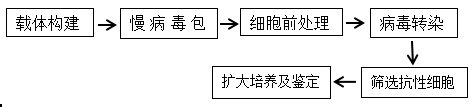
三、实验方法
1、目的细胞的合适抗生素浓度筛选;
2、目的细胞的合适病毒滴度筛选;
3、慢病毒构建与包装与滴度测定;
4、慢病毒感染;
5、特定抗生素筛选稳转细胞株;
6、稳转细胞株鉴定。
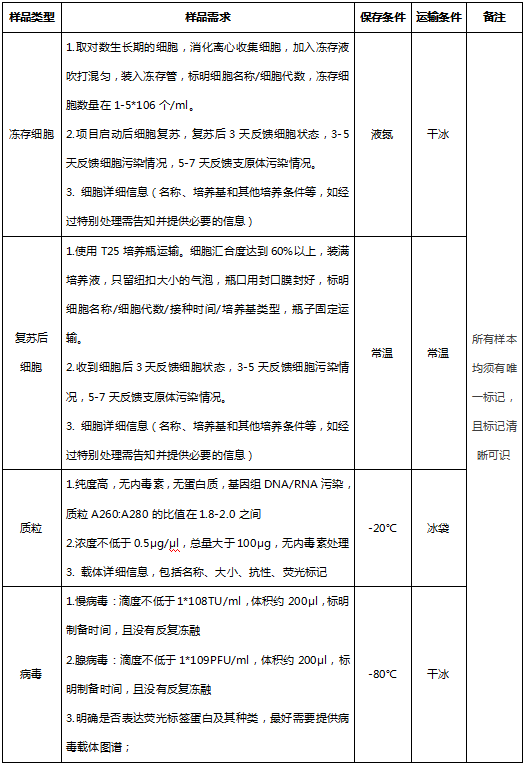
四、样本送检要求
五、案例展示
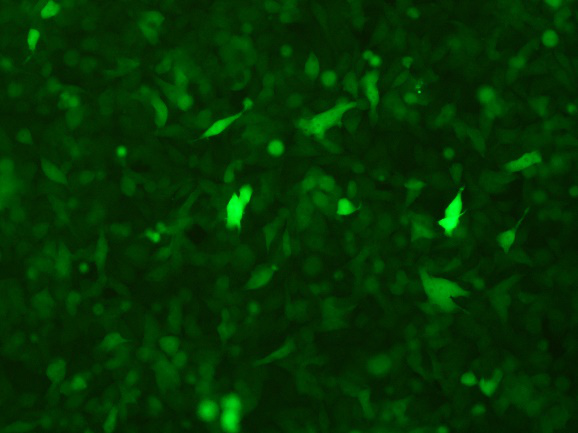
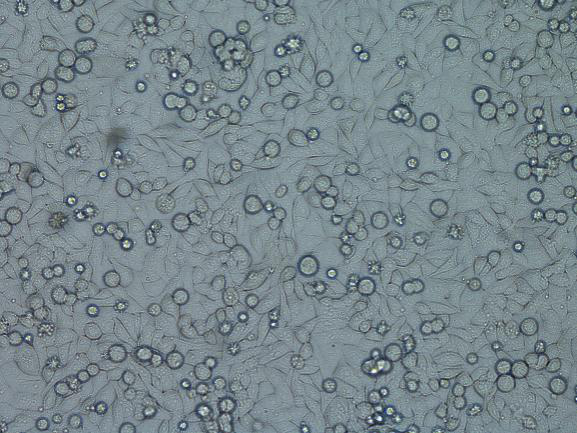
多克隆稳转株
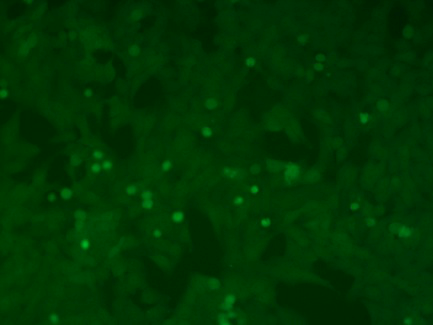
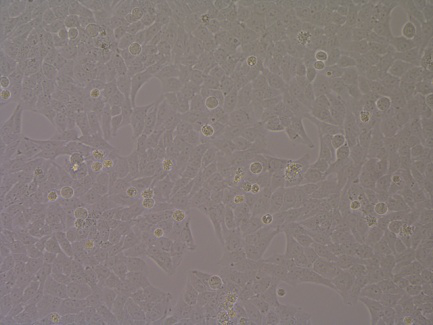
单克隆稳转株
六、常见问题
1.支原体污染问题
由于轻度的支原体污染并不影响细胞的生长和增殖,故被许多实验室所忽略。但支原体易在病毒感染细胞后爆发,出现大量细胞碎片,甚至导致细胞死亡,导致稳转株筛选的失败。我们建议在稳转株构建之初,务必排除细胞及培养环境中的支原体污染。
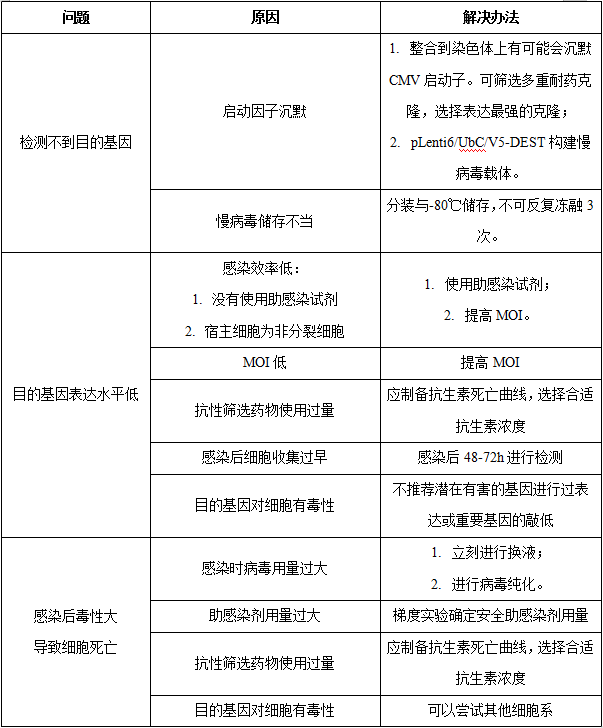
2.其他问题
除支原体污染之外,还有以下问题会经常出现于稳转株构建中。
七、服务流程