根据全球权威的临床试验登记网站ClinicalTrials.gov网站显示,“复必泰”中国Ⅱ期临床试验的预计结束日期延期至10月30日。这项由BioNTech公司登记的Ⅱ期临床试验于2020年12月启动,试验共入组950人,主要研究疫苗在中国大陆健康人群中的安全性,原计划于2021年12月结束,后延期至今年4月30日,如今却再度被延期半年!
市场翘首以盼,复必泰商业价值不可限量从2020年3月,复星医药控股子公司复星医药产业与德国BioNTech签订协议,通过支付8500万美元许可费与35%的毛利销售提成等合作条款,获授权“复必泰”在中国大陆及港澳台的独家开发与商业销售,这款疫苗的国产化进程就一直备受关注。
去年7月,复星医药董事长吴以芳曾表示,疫苗的“审定工作基本完成,正在加紧进行行政审批”,这一度被业内视为复必泰即将上市的信号。今年3月,吴以芳再度回应复必泰的上市进展时,态度则略显保守,回应称“还在审批,没有更多的消息。”然而,此次再度传出的临床延期消息,让“复必泰”在大陆地区上市蒙上阴影(图1)。

图1 复必泰的国产化之路(图源:生物探索编辑团队原创)
一直以来,这款mRNA疫苗的商业价值是有目共睹的。正是凭借此款疫苗产品,辉瑞公司在2021年度实现了高达367.8亿美元的总营收,重新夺回全球制药Top1的宝座;此外,根据最近的Q1财报,辉瑞在2022年第一季度也实现了132.3亿美元的高营收,远远高于上年度同期水平(相关阅读:重夺全球制药Top1?从年度财报看这家公司的实力)。在辉瑞赚得盆满钵满之际,然而复必泰仅在我国港、澳、台三地投入使用。在2021年报中,虽然复星医药并未披露复必泰在港澳台地区的具体营收,但在制药板块销售规模超10亿的3种产品当中,复必泰占据首位,使其一举成为复星医药三大超10亿营收的龙头产品。
此前任何一点风吹草动都能引发市场对于复必泰获批的期盼,而复星医药也多次表示早已为复必泰上市做好随时待命的准备。尽管市场翘首以盼,复星医药也已随时待命,复必泰上市的消息至今仍未能等到。如今Ⅱ期临床试验再度延期,似乎上市更是前路漫漫。
风靡世界的mRNA疫苗,有何神奇之处?
mRNA疫苗作为一种通过体外转录构建的核酸疫苗,可将病毒无害的小片段呈现给免疫细胞“学习”并“演练”如何识别和攻击病毒,在下次“真枪实战”时可快速产生特异性免疫反应,从而防止病毒在人体复制和传播(图2)。mRNA疫苗具备无病毒感染风险、研发周期短和拥有双重免疫机制等突出优势。
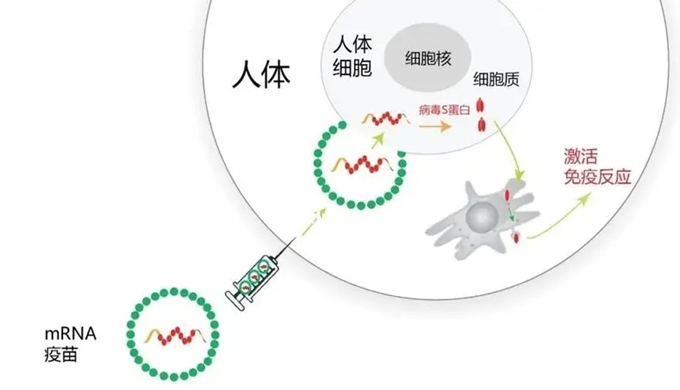
图2 mRNA疫苗的作用机制(图源:健康界)
近年来,国内企业对布局mRNA技术路线保持如此高的热情,不单单是因为辉瑞、莫德纳两家巨头的mRNA产品获得全球市场的优异反馈,更是考虑到mRNA新冠疫苗基础免疫的保护效力临床数据表现优异,三针加强针后对变异株的保护力也有明显提升,超越其他技术路线的新冠疫苗。对此,张文宏教授和钟南山院士都曾公开表达过此观点。
3月24日,华山医院感染科主任张文宏教授发微博称,“根据香港疫苗有效性数据,灭活疫苗和mRNA疫苗都可以预防严重疾病和死亡。在年龄≥60岁的成人中,灭活冠状病毒两针接种对重症新冠与死亡的保护率为74.1%,但仍不如BNT162b2(有效率88.2%)。”
4月,在钟南山院士为南开学子公开授课《科学指导抗疫,勇攀医学高峰》时,分享了在巴西开展的异源性疫苗接种的真实世界数据。数据显示,两针科兴疫苗,再用mRNA疫苗加强免疫14-30天后,预防感染率可高达92.7%,预防重症达97.3%(图3)。

图3 钟南山院士公开授课(图源:[2])
国产mRNA疫苗研发接连迎突破
据统计,国内聚焦mRNA药物研发的创新企业有十余家,主要有艾博生物、丽凡达生物、蓝鹊生物、斯微生物等(表1)。值得一提的是,在这其中斯微生物是国内最早致力于mRNA技术的制药公司,其他聚焦mRNA领域的公司多成立于2018年以后。
表1 国内聚焦mRNA药物研发的创新企业
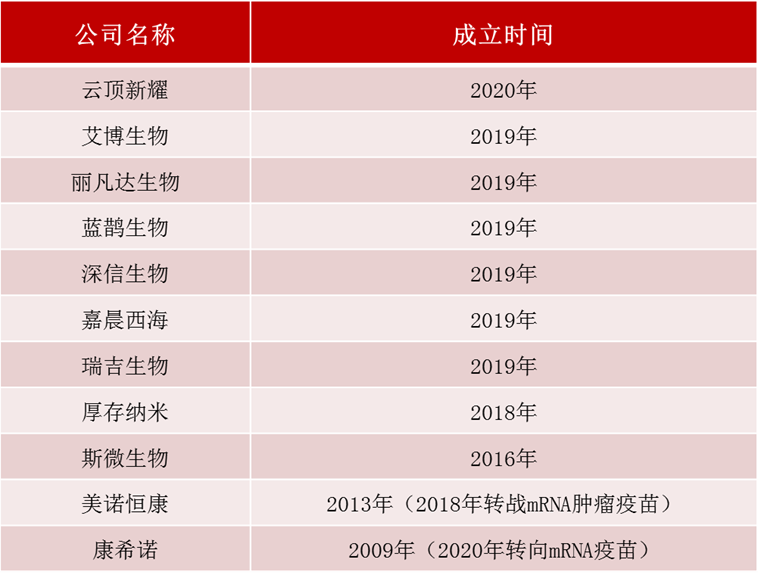
数据来源:[1]丨制表:生物探索编辑团队
注:美诺恒康虽成立于2013年,但该公司最初创立时主营外包服务,于2018年开始转战研发mRNA肿瘤疫苗。成立于2009年的康希诺,自2020年开始转向mRNA疫苗研发。
目前,国内暂无mRNA疫苗获批上市。据不完全统计,截至目前,国内已有7家企业的mRNA疫苗候选药物进入临床阶段,其中5款已处于I和II期临床试验阶段,2款获得国家药监局的IND审批,即将进入临床阶段,具体进展可见表2。
表2 国内新冠mRNA疫苗研发临床进展
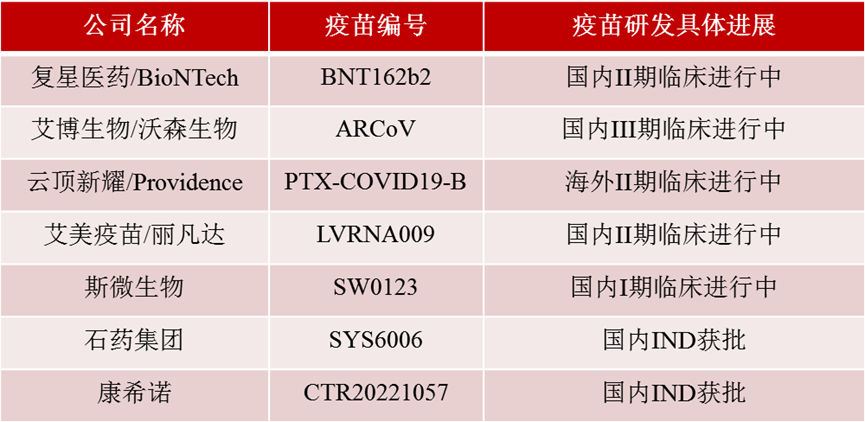
数据来源:[1]丨制表:生物探索编辑团队
艾博生物&沃森生物(ARCoV)
2019年,艾博生物在苏州成立,致力于基于核酸(siRNA,mRNA,DNA)的新药研发。2020年6月,艾博生物联合军事科学院军事医学研究院、云南沃森生物共同研制的新型冠状病毒mRNA疫苗(ARCoV),正式获得IND批准,进入临床I期研究阶段。
2022年1月24日,《柳叶刀-微生物》刊登了浙江大学医学院附属第一医院李兰娟院士团队对mRNA疫苗ARCoV的安全性、耐受性和免疫原性研究,正式公布这款新冠mRNA疫苗ARCoVaX(ARCoV)的I期临床试验数据。该项题为“Safety and immunogenicity of the SARS-CoV-2 ARCoV mRNA vaccine in Chinese adults: a randomised, double-blind, placebo-controlled, phase 1 trial”的研究数据显示,ARCoV在所有五组剂量下安全性耐受性良好,并可诱导强烈的免疫反应(图4)。

图4 研究成果(图源:[3])
云顶新耀&Providence(PTX-COVID19-B)
2021年9月,云顶新耀宣布与Providence Therapeutics公司达成合作,获得Providence公司的mRNA新冠候选疫苗在大中华区、东南亚、巴基斯坦等亚洲新型市场的授权许可,同时也引进Providence的mRNA技术平台,在全球进一步合作开发mRNA产品。公司获得mRNA疫苗整个制造过程的全部技术转让。
2021年5月,Providence宣布了I期临床的中期数据。I期临床数据显示,接受过PTX-COVID9-B治疗的受试者的血清在第28天显示出中和活性,而接受安慰剂治疗的受试者均未产生中和抗体。在第二次注射两周后,中和抗体滴度随着剂量的增加和时间的推移而增加。第42天的中和效价比新冠康复患者的中和水平高出10倍以上。
2021年12月,云顶新耀与Providence Therapeutics共同宣布,PTX-COVID19-B已加入世界卫生组织的新冠疫苗团结试验(Solidarity Trial Vaccines)(图5)。目前,PTX-COVID19-B正处于全球II期临床试验阶段。此外,云顶新耀和Providence还合作开发针对Omicron的下一代mRNA疫苗。
图5 WHO组织的新冠疫苗团结试验(图源:[4])
艾美疫苗&丽凡达(LVRNA009)
成立于2019年,艾美疫苗控股子公司丽凡达生物公司自主开发的mRNA基因制药平台多线推进传染病疫苗、癌症疫苗、蛋白补充治疗等一系列创新型生物药的研发、生产和上市,拥有自主mRNA生产和药物递送技术平台,在药物设计、生产和制剂递送方面已拥有多项发明专利。
2021年3月,艾美疫苗控股子公司丽凡达开发的新冠mRNA疫苗(LVRNA009)获得IND批准。2022年1月8日,LVRNA009的I期临床试验数据显示,总的不良事件发生级别都为1-2级,没有发生3级以上的不良事件,因此LVRNA009具备良好的安全性和耐受性。3月,丽凡达启动新冠mRNA疫苗的II期临床试验,旨在评估该疫苗在中国18-59岁人群中接种的免疫原性和安全性。
斯微生物(SW0123)
2016年,斯微生物由海归科学家创立,其致力于打造中国领先的mRNA药物平台和产品管线。2017年7月,休斯顿卫理会医院授予斯微生物在LPP(lipopolyplex)递送平台的全球独家商业化权益。
目前,斯微生物针对野生株的第一代mRNA疫苗I期临床试验已经结束,数据显示安全性良好。针对变异株的二代新冠mRNA疫苗在老挝正开展I/II期临床试验;此外,斯微生物已经获得巴西的临床I期、II期、III期的批件。根据初步动物实验,这款疫苗对于Delta、Beta等变异株都具有非常好的保护效果。
注:LPP纳米递送平台是一种以聚合物包载mRNA为内核、磷脂包裹为外壳的双层结构。LPP的双层纳米粒和传统的LNP相比具有更好的包载、保护mRNA的效果,并能够随聚合物的降解逐步释放mRNA分子。
石药集团(SYS6006)
SYS6006为石药集团自主研发的、针对新冠病毒变异毒株的mRNA疫苗。通过针对性的抗原突变设计,临床前研究表明其对包含Omicron和Delta在内的主流突变毒株都具有良好的免疫保护效力,通过体液免疫和细胞免疫对机体提供免疫保护,并可产生记忆B细胞,提供长效保护力。此外,安全性方面也得到临床前安全性评价数据证明。2022年4月4日,石药集团生产的mRNA疫苗SYS6006获得国家药监局IND批准。
此外,SYS6006使用先进的生产技术,产业化能力强,稳定性好,可在2-8°C长期储藏。此外,在供应链上,公司对mRNA技术的关键生产原料和辅料实现了内化生产和国产化替代,可满足大规模产能供应需求。基于综合优势,SYS6006被NMPA列入特别审批程序,被快速批准进入临床。后续公司将全力推进该产品的国内及国际多中心临床研究工作,力争尽快上市。
康希诺(CTR20221057)
2009年,康希诺成立于天津,致力于为中国及全球公共卫生研发、生产和商业化创新疫苗。公司现有四个创新疫苗平台技术,包括腺病毒载体疫苗技术、结合技术、蛋白设计与重组技术、制剂技术。公司在mRNA合成和递送技术上布局多年,已申请多项关于mRNA疫苗设计和新型递送系统设计的专利。
根据临床前结果显示,该款疫苗可以诱导出针对多种WHO认定的重要变异株(包括当前流行株)的高滴度的中和抗体,与以原型株为基础开发的现有新冠疫苗相比广谱性更强,可以更为有效保护机体免受现有变异株的感染。
2021年年底,康希诺生物与上海医药合作建设的mRNA疫苗生产厂房完成交付,并获得上海首张新冠疫苗生产许可证,预计今年年底前将具备大规模商业化生产条件。2022年4月4日,公司生产的mRNA疫苗获得国家药监局IND批准。5月5日,康希诺登记启动了新冠mRNA疫苗的I期临床试验,针对18岁及以上成年人,试验登记号为:CTR20221057。
综上,由于mRNA疫苗所具有的独特技术优势,以及它在免疫保护方面的优越性,我国民众一直对mRNA翘首以盼。目前,我国多家企业也正纷纷布局mRNA技术平台,投入到mRNA疫苗的研发中。小编相信在此种争相竞技的氛围下,我们将接连见证新的突破,早日见证国产mRNA疫苗实现“零”的那一天!
医刊汇,科研学术服务平台
医刊汇是一家专业从事生物医学领域服务的公司,提供SCI医学论文、医学课题研究、医学科研服务、SCI解决方案、医学专利申请、知识产权服务、医学图书出版等专业学术综合服务。成立至今,专注于提供医学科研解决方案的专业咨询服务,已赢得众多科研工作者的好评。
我们的科研团队由来自全国知名医学院校的硕博研究员组成,是一支拥有丰富的医学科研理论以及实操经验的研究团队,能深层次挖掘客户需求,为广大医学科研工作者解决无暇顾及的临床科研以及因科研条件落后而无法开展实验研究的问题,帮助其提供更专业、更全面的医学科研整体课题服务。
未来公司将继续秉承“尊重科学,求真务实,服务领先,客户至上”的服务理念,与全国数十家三甲医院、高等院校研究所建立长期战略合作关系,坚持不懈地提升产品和服务的质量,并将依托快捷高效的科学研究协助平台以及丰富的生物医学资源,努力为广大医生、学者提供专业的生物医学研究、SCI解决方案、成果转化等综合性服务。
