近日,浙江大学医学院/良渚实验室张进研究团队发表一系列巨噬细胞领域综述和研究成果。
张进团队于2021年在 Kidney Diseases 期刊上发表了题为:Macrophage-Based Combination Therapies as a New Strategy for Cancer Immunotherapy 的综述论文。
该文章首先介绍了肿瘤相关巨噬细胞(TAMs)在肿瘤进展中所扮演的独特作用,继而通过对巨噬细胞自身免疫属性和功能的介绍,系统性的阐明了其在肿瘤治疗中的优势和临床应用前景。
文章提到,具有M2免疫抑制特性的TAMs占据了实体肿瘤浸润性免疫细胞的50%以上,并可通过多种渠道促进实体肿瘤的发生和发展。如通过分泌EGF等生长因子促进肿瘤细胞的增殖和侵袭;通过分泌VEGF、MMPs等促血管新生因子促进肿瘤微环境中血管的新生;通过分泌TGF-β、IL-10等免疫调节因子营造实体肿瘤中免疫抑制性的微环境,继而为肿瘤细胞免疫逃避提供了“保护伞”。另一方面,作为免疫系统的一员,巨噬细胞本身具有抗原依赖性的吞噬作用(ADCP),以及抗原呈递和调节各类免疫反应的作用。
正是基于此,基于巨噬细胞的实体肿瘤治疗方案成为了治疗实体肿瘤的可行性选择。
同时,维持肿瘤微环境中巨噬细胞的M1特性是发挥其抗肿瘤作用的关键。文中提到,可通过多途径重塑TAMs,使其由M2免疫抑制状态向M1免疫激活状态极化,继而发挥抗肿瘤功效(图1)。例如,通过改变TAMs胞内糖代谢和脂代谢途径使其向M1转变,CD47抗体阻断TAMs中“don't eat me ”信号,CD40和TLR等表面膜蛋白的激动剂唤醒TAMs免疫活性等。然而这一类方法无法摆脱巨噬细胞难以驾驭的局限性,难以起到治本的功效。
针对这一问题,文章介绍到,借助CAR-T的策略并通过基因工程化手段改造巨噬细胞得到具有靶向杀伤功效和抗原依赖性激活潜力的CAR-巨噬细胞将会是实体肿瘤免疫细胞治疗的有力参与者。
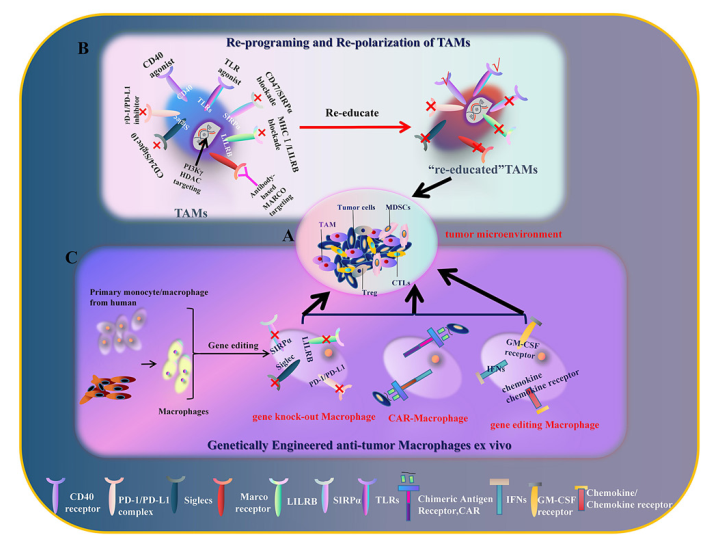
图1.重塑TAMs和构建CAR-巨噬细胞的策略
针对目前巨噬细胞在业内所取得的广泛关注和方兴未艾的研究热情。近日,张进研究团队联合福建医科大学的张毅团队在 Cells 期刊发表了题为:Induced CAR-macrophages as a novel therapeutic cell type for cancer immune cell therapies 的 perspective 文章。
该文章总结性的介绍了目前应用于肿瘤免疫细胞治疗研究的CAR-巨噬细胞的三种主要来源,即 PBMC、THP1 和 iPSC(图2)。
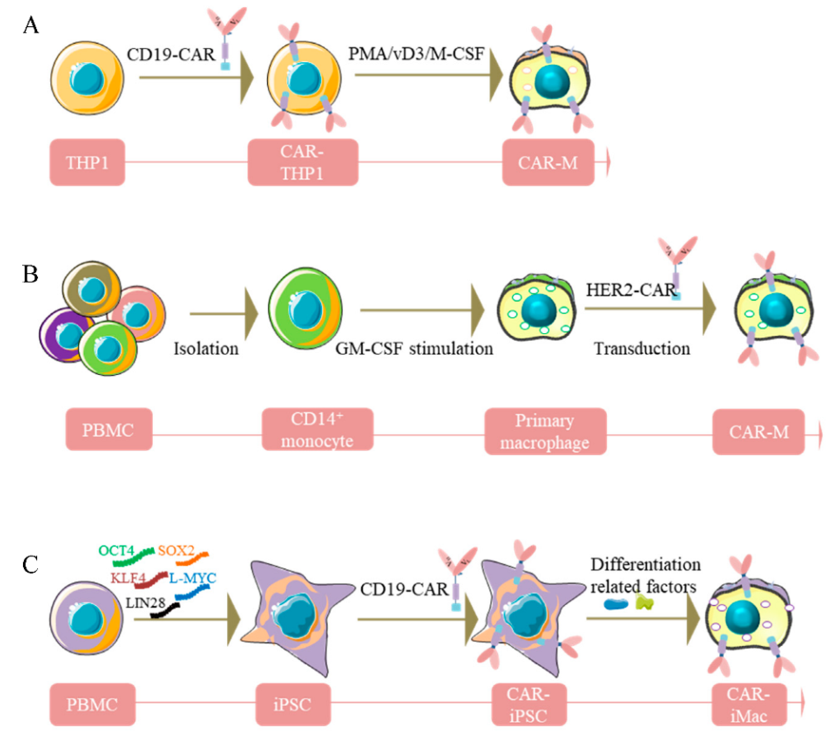
图2. CAR-巨噬细胞的三种不同来源
通过总结最新的研究成果,该论文对比了不同来源的CAR-巨噬细胞在实体肿瘤治疗中展现出来的优劣势,并认为 iPSCs 来源的CAR-巨噬细胞以其“robust”、“genetic manipulation-friendly” 和“unlimited”等方面的优势突破了传统病人自体PBMC来源的巨噬细胞治疗策略中制备周期长、细胞数量少、难以基因工程化改造等方面的缺陷,因而具备更高的肿瘤免疫细胞治疗研究价值和临床应用价值。
值得一提的是,基因工程化改造的CAR-巨噬细胞在理论上可有效改善肿瘤微环境,在发挥自身抗肿瘤功效的同时使实体肿瘤由“冷肿瘤”向“热肿瘤”转变(图3)。该论文给目前基于巨噬细胞的抗肿瘤研究指明了更加清晰的方向。
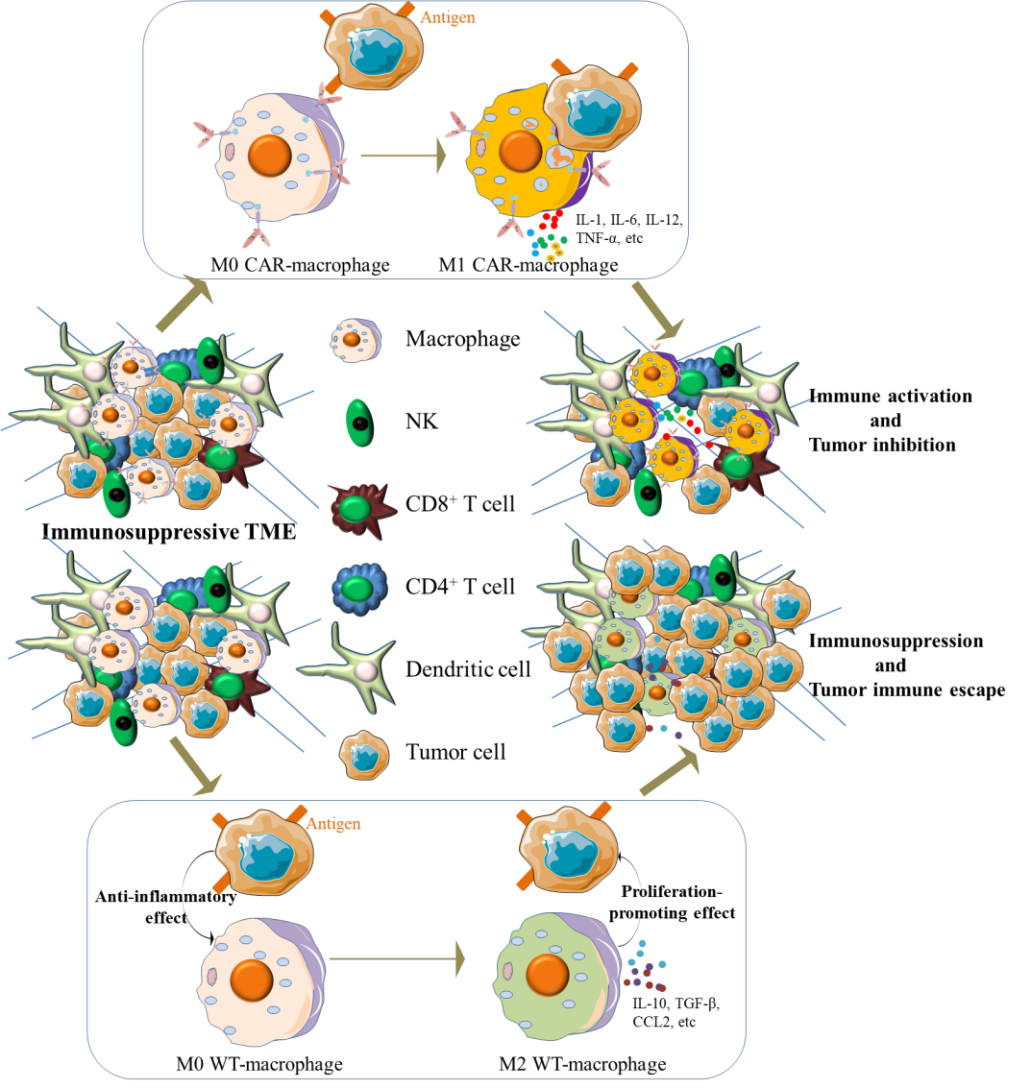
图3. CAR-巨噬细胞发挥抗肿瘤功效并改善肿瘤微环境
基于以上理论基础,针对肿瘤的治疗,张进课题组对 iPSCs 分化巨噬细胞(iMacs)展开了大量的探索,形成了成熟的技术体系。同时,创新性的运用基因工程化手段将来源于CAR-T的CAR(T-CAR)引入iMacs中,进而得到了第一代CAR-iMacs,实现了巨噬细胞靶向杀伤和抗原依赖性激活的设想。
该结果于2020年以:Pluripotent stem cell-derived CAR-macrophage cells with antigen-dependent anti-cancer cell functions 为题发表在了 J Hematol Oncol 期刊上。
该项成果表明iMacs具备先天性巨噬细胞完整的表达谱和功能。同时,靶向CD19的CAR(CD19)-iMacs对血液肿瘤细胞,靶向Mesothelin的CAR(meso)-iMacs对卵巢癌细胞均有比较理想的靶向杀伤效果。小鼠肿瘤模型中的抗肿瘤实验也证实了这一结果。可喜的是CAR的引入也显著性的增强了IL-1B、IL-6、TNF-α等炎症因子的表达,表明CAR-iMacs在识别特异性抗原后具备了改善免疫微环境的潜能。
值得注意的是iMacs在小鼠体内的生存周期长达30多天。这一理想生存时间为CAR-iMacs持续抗肿瘤功效的实现奠定了可能。
然而,也正是因为较强的可塑性,巨噬细胞在不同的生理条件下可展现出截然不同的极化状态,即“Classically Activated”M1极化状态和“Alternatively Activated”M2极化形式。
如何阻止CAR-iMacs被肿瘤细胞裹挟继而演变为促癌的M2型CAR-iMacs是实现其持续治疗效果和药用价值的关键。
张进课题组的研究证实T-CAR虽然实现了CAR-iMacs的抗原依赖性激活,也一定程度上刺激了免疫相关因子的表达。但不具备维持CAR-iMacs向M1状态持续极化的功效。因此,设计一款巨噬细胞专属并具有M1极化促进作用的CAR(M-CAR)就成为了推进CAR-iMacs抗肿瘤研究的关键。
近日,张进课题组在 Springer Nature 预印本平台 Research Square 上发表了一项第二代 CAR-巨噬细胞研究论文。
借助 CAR 转导胞内信号的原理,研究团队创新性的将介导 M1 极化的分子的信号转导结构域引入 CAR 的设计中,构建了具有可控的 M1 极化功能的巨噬细胞专属 CAR ——M-CAR。将该M-CAR稳定表达在iPSCs中,继而分化得到了 M1-CAR-iMacs。接下来的体外肿瘤细胞杀伤和荷瘤小鼠模型中的抗肿瘤实验均验证了M1-CAR-iMacs可观的抗癌功效和抗原依赖性的M1极化能力。该策略在大大增强了CAR-iMacs抗肿瘤效果的同时,也进一步的提高了其分泌了IL-1B、IL-6、TNF-α等促炎因子水平。随后的单细胞测序也表明,相较于第一代CAR-iMacs,M1-CAR-iMacs具有在肿瘤微环境中可观的M1持续极化水平。这一策略将CAR-iMacs的抗肿瘤研究推进了一大步。此外课题组也在采用代谢重编程的手段赋予CAR-iMacs更强的抗肿瘤功能,为后续CAR-iMacs的更多应用打下坚实的基础。
以上工作得到了浙江大学医学院、良渚实验室、浙江大学医学中心、浙江大学医学院附属第一医院、浙江省基因细胞治疗与基因组医学工程研究中心的支持。由浙江大学医学院的雷安华、田琳(现吉林大学)和福建医科大学的苏思钰等主要参与完成。
医刊汇,科研学术服务平台
医刊汇是一家专业从事生物医学领域服务的公司,提供SCI医学论文、医学课题研究、医学科研服务、SCI解决方案、医学专利申请、知识产权服务、医学图书出版等专业学术综合服务。成立至今,专注于提供医学科研解决方案的专业咨询服务,已赢得众多科研工作者的好评。
我们的科研团队由来自全国知名医学院校的硕博研究员组成,是一支拥有丰富的医学科研理论以及实操经验的研究团队,能深层次挖掘客户需求,为广大医学科研工作者解决无暇顾及的临床科研以及因科研条件落后而无法开展实验研究的问题,帮助其提供更专业、更全面的医学科研整体课题服务。
未来公司将继续秉承“尊重科学,求真务实,服务领先,客户至上”的服务理念,与全国数十家三甲医院、高等院校研究所建立长期战略合作关系,坚持不懈地提升产品和服务的质量,并将依托快捷高效的科学研究协助平台以及丰富的生物医学资源,努力为广大医生、学者提供专业的生物医学研究、SCI解决方案、成果转化等综合性服务。
